为期4年,医疗器械大检查启动
2024年2月28日 来源:器械注册研发人
近期,云南、海南、山东、四川等多地发布2024年医疗器械检查计划,重点品类、企业、医疗机构名单公布。
01力争四年完成全覆盖,重点关注这些品类
近期,海南省药监局制定印发了2024年医疗器械经营使用监督检查计划。
《检查计划》明确,全省各级医疗器械监管部门依职责开展监督检查工作,各市县局检查医疗器械经营企业使用单位数量均不得少于本行政区域总数的25%,力争四年完成全覆盖。
《检查计划》强调,持续开展无菌和植入、集采中选、医疗美容、青少年近视防治、辅助生殖类、网络销售医疗器械等领域专项整治。
重点关注呼吸机、医用口罩、冠脉支架、人工晶体、隐形眼镜、眼用粘弹剂、注射用透明质酸钠凝胶、射频治疗仪、辅助生殖导管、辅助生殖专用仪器、避孕套、婴儿保温箱、一次使用输液注射器具等群众使用量大面广、社会关注度高的产品。
按照企业经营资质、产品资质、购销渠道、运输储存、不良事件监测、记录追溯、异地设库、直调购销等经营使用质量管理方面的要求,重点检查抽检不合格、监督检查中存在严重缺陷项或者整改不到位、自查不彻底、集中带量采购中选、异地设库、网络销售、自动售卖机销售、长期停业后恢复经营、风险会商发现问题多的经营使用单位。
《检查计划》要求,加强同网信、公安、卫健、海关、综合执法等部门协同监管和联合惩戒,共同打击违法违规行为;督促企业开展医疗器械法律法规及新版经营质量管理规范培训,持续改进企业经营质量管理体系;综合运用提示、警示、约谈、督办、责令等多种手段处置风险。
02多地启动器械检查
部分地区公布详细检查名单
开年以来,多地对2024年医疗器械监管进行部署。
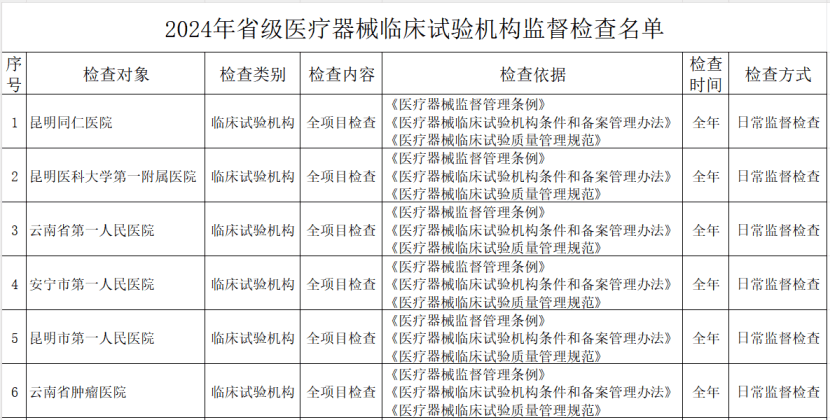
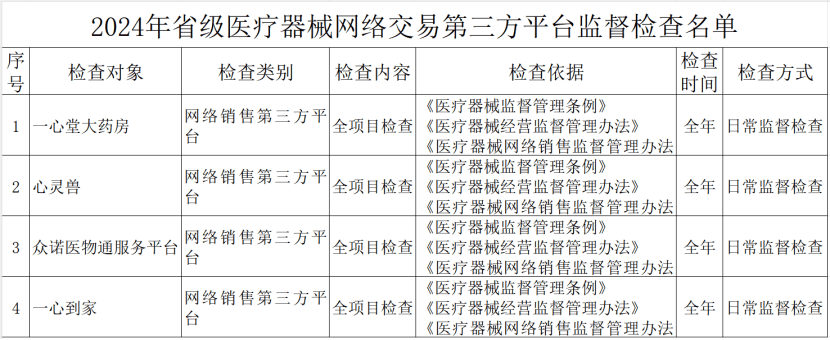
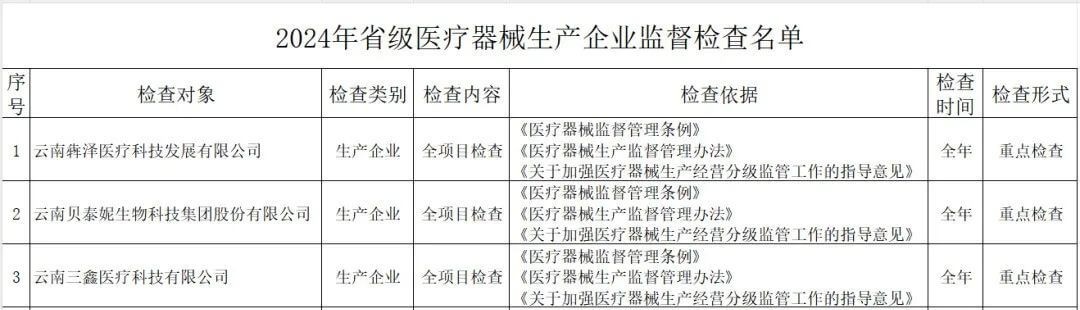
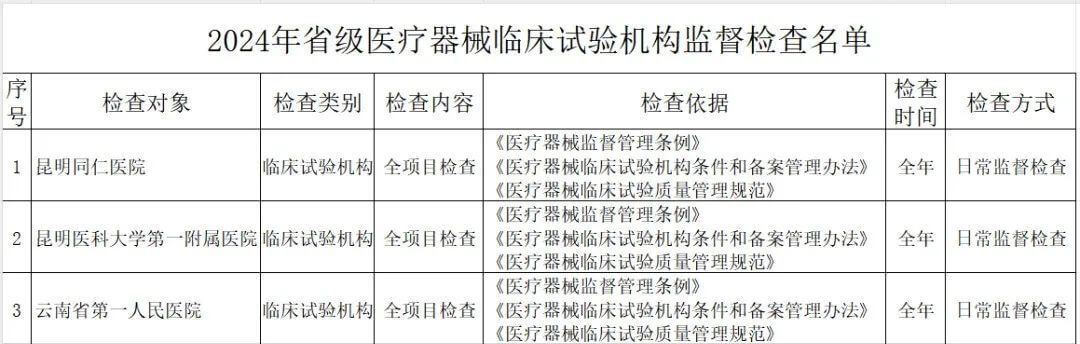
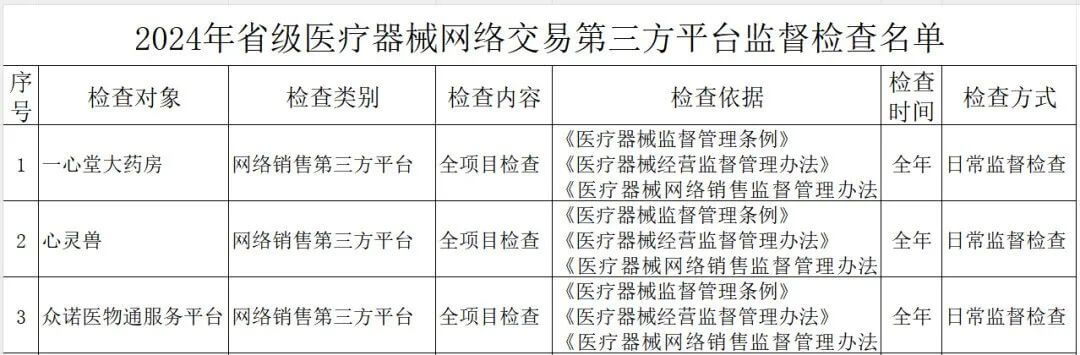
其中,云南省药监局发布了《2024年省级医疗器械监督检查计划》,检查范围包括医疗器械生产企业、医疗器械临床试验机构及医疗器械网络交易第三方平台,其中公布了详细的检查名单。
(完整名单附文末)
检查要求如下:
(一)医疗器械生产企业。包括生产风险分级为一般风险、较高风险和高风险的生产企业。对风险分级为高风险的医疗器械生产企业实施四级监管,每年全项目检查不少于一次;对风险分级为较高风险的医疗器械生产企业实施三级监管,每年检查不少于一次,其中每两年全项目检查不少于一次;对风险分级为一般风险的医疗器械生产企业实施二级监管,每两年检查不少于一次。
(二)医疗器械临床试验机构。抽取云南省辖区内50%的临床试验机构开展GCP全项目监督检查。
(三)医疗器械网络交易第三方平台。全覆盖。
监督检查应在2024年11月30日前完成,并于2024年12月10日前将检查情况报云南省药监局医疗器械处。
《检查计划》明确,坚持问题导向,针对突出问题和监管风险,将日常监督检查、飞行检查、专项检查有机结合,综合运用监督检查、监督抽检、不良事件监测、稽查执法、投诉举报等形式强化监督管理,不断压实企业主体责任,坚决守住医疗器械质量安全底线。
山东省药监局印发《2024年全省医疗器械生产企业监督检查计划》,部署开展2024年医疗器械生产检查工作。
其中明确,加强对集采中选、无菌和植入类、医用防护类、医疗美容、青少年近视防治、辅助生殖、体外诊断试剂、避孕套、创新医疗器械等重点产品和既往发现问题较多、抽检不合格、间歇生产、风险较高的委托生产注册人和受托生产企业等重点对象的检查力度。
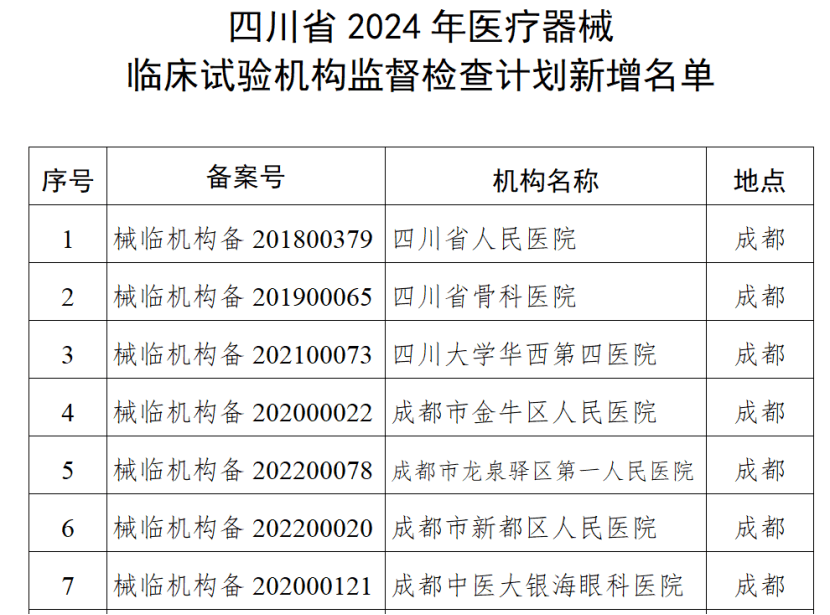
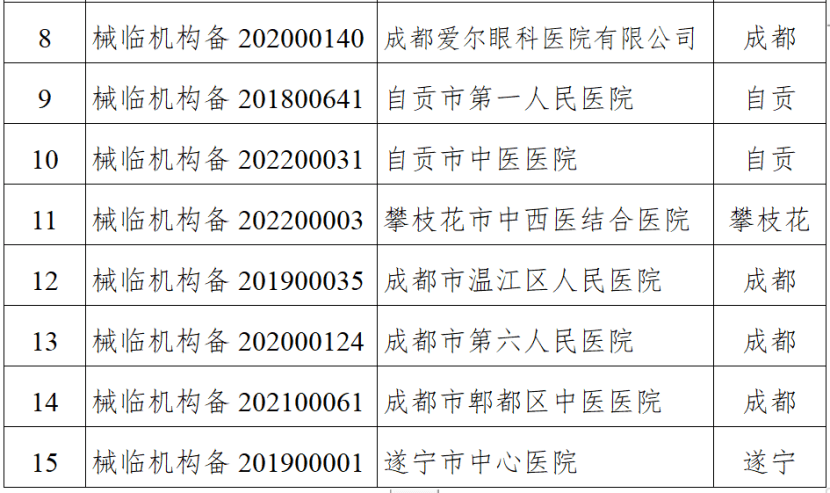
四川省药监局发布《关于增加2024年四川省医疗器械临床试验机构监督检查家次的通告》,新增15家医疗器械临床试验机构,列入2024年度医疗器械临床试验机构监督检查计划。

03 2024医疗器械监管全面升级
整体来看,医疗器械监管强度明显加大,对违法违规行为的惩治也更趋严格。
去年6月,国家药监局部署开展为期一年半的药品安全巩固提升行动。这一行动在2024年还将继续发力。
其中包括,对高风险、既往发现问题较多的企业采取“四不两直”、飞行检查等方式加大现场监督检查频次,加大对医疗美容药品医疗器械等重点领域违法违规行为的整治力度。
此外,高压严打违法违规行为。一是持续强化案件查办。落实违法行为“处罚到人”规定,完善重大案件挂牌督办制度,综合运用典型案例曝光、严重违法失信名单公示等手段,实施联合惩戒、行业禁入、从业禁止。
二是持续强化协同联动。加强国家、省、市、县四级药品监管部门有机联动,消除监管盲点盲区。三是加强跨部门协同查办。会同公检法机关进一步完善行刑衔接机制,与有关部门进一步加强联动,建立完善跨部门风险会商制度。
1月18日至19日,2024年全国医疗器械监督管理工作会议召开。会议对2024年医疗器械监管工作部署五项重点任务:
以加快高端医疗器械产品上市为重点,持续深化审评审批制度改革;以加强审评能力建设为重点,全面加强注册备案管理;以严查大案要案为重点,深化巩固提升行动;以严控安全风险为重点,强化全生命周期质量安全监管;以加快推进医疗器械管理法起草为重点,加快完善监管基础支撑体系。
医疗器械监管新形势下,产业发展也将进入新周期。
附: